Carbonate
Le carbonate est, en chimie, un ion constitué d'un atome de carbone et de trois atomes d'oxygène portant une double charge électrique négative, ou un composé chimique comprenant cet anion.
Définitions :
- (nm) : Minéral constitué d'un ion CO 3 2- et d'un cation portant 2 charges positives, le plus fréquemment Ca 2+. (source : lfmadrid)
Le carbonate est , en chimie, un ion constitué d'un atome de carbone et de trois atomes d'oxygène portant une double charge électrique négative (CO32-), ou un composé chimique comprenant cet anion.
Sur terre, sur le long terme, les carbonates jouent un rôle majeur dans le rétrocontrôle du climat et des gaz à effet de serre via le cycle du carbone. Ils forment (dans le manteau terrestre, après sédimentation dans les océans et en particulier sous forme de carbonate de calcium) la majeure partie des puits («durables») de carbone[1].
Quelques exemples de carbonates :
Structure
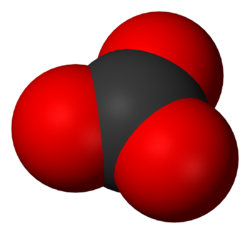
Dans l'ion carbonate CO32-, chaque atome de carbone se trouve au centre d'un triangle équilatéral dont chaque sommet est occupé par un atome d'oxygène.
Aucun ion oxygène n'est commun à deux groupements triangulaires carbone-oxygène ; ceux-ci doivent être reconnus comme des unités différentes dans la structure des minéraux carbonatés et ils sont en grande partie responsables des propriétés spécifiques de ce groupe.
La liaison entre le carbone central et les oxygènes est moins forte que dans le dioxyde de carbone. En présence de l'ion hydrogène, le radical carbonate devient instable et se brise. Cette instabilité est à l'origine des tests à l'acide qui permettent de reconnaître les carbonates dans un composé organique ou inorganique. Au contact d'une solution d'acide chlorhydrique HCl, les ions CO32- forment du dioxyde de carbone CO2, dont le dégagement gazeux est observable sous forme d'effervescence.
Quand l'ion carbonate est combiné avec les cations divalents (Ca2+, Fe2+`…), il forme des composés de structure géométrique simple, le plus souvent rhomboédrique ou orthorhombique. Le carbonate de calcium se cristallise à la fois avec la structure rhomboédrique de la calcite et la structure orthorhombique de l'aragonite.
Propriétés
Les carbonates sont des minéraux qu'on trouve en abondance à la surface de la Terre. Le carbonate de calcium est le constituant principal des coquilles de nombreux organismes. On le retrouve en particulier dans la lithosphère sous forme de roches dites calcaires, les plus abondantes parmi les roches sédimentaires. Ce stock énorme de carbone est alimenté par le métabolisme des êtres vivants sous forme de dioxyde de carbone, lequel donne surtout, en se combinant avec les métaux divalents, des composés insolubles dans les conditions normales de la lithosphère : les carbonates. Des dissociations ultérieures peuvent cependant intervenir, à la faveur desquelles le carbone mis en réserve est restitué à la biosphère ainsi qu'à l'atmosphère. Ainsi les carbonates se trouvent à la croisée des cycles biochimique et géochimique du carbone, situés principalement dans la zone superficielle de la lithosphère. La présence des carbonates dans les roches d'origine interne est , en effet, exceptionnelle et elle pose l'un des problèmes les plus intéressants de la pétrologie, celui de l'origine «primaire» du carbone en profondeur.
Les carbonates alcalins ne se dissocient qu'à particulièrement haute température, les carbonates alcalino-terreux et le carbonate de lithium à température moins élevée ; la température à laquelle une pression déterminée de dioxyde de carbone est atteinte décroît du carbonate de baryum au carbonate de magnésium, en passant par le strontium puis le calcium. Les carbonates alcalins solubles dans l'eau sont hydrolysés.
Carbonate de calcium
Les roches carbonatées sont des roches sédimentaires composées d'une grande proportion de carbonate ; fréquemment du carbonate de calcium (CaCO3).
Exemples :
Il existe plusieurs variétés minéralogiques du carbonate de calcium, ces deux types différant par leur dispositif cristallin. il s'agit de la calcite (système rhomboèdrique) qui est la forme la plus stable et l'aragonite (système orthorhombique) qui est la forme qui cristallise naturellement dans les océans actuels. Une autre variété est la vatérite, mais cette forme est rare car particulièrement instable dans les conditions de pression et de température normales.
Différents types de carbonates
- carbonate de calcium et de magnésium : dolomite ;
- carbonate de fer : sidérite ;
- carbonate de cuivre : malachite ;
- carbonate de sodium et bicarbonate de sodium : natron ;
- carbonate de calcium, fer, manganèse et magnésium : ankérite ;
- carbonate d'uranyle
- carbonate de plomb : cérusite. Le carbonate de plomb, de formule (PbCO3) 2 Pb (OH) 2, nommé blanc de plomb ou céruse, est utilisé depuis plus de deux mille ans comme pigment blanc. Il sert aussi d'enduit pour la céramique et pour la fabrication d'autres pigments. Du fait des dangers d'empoisonnement par le plomb, l'utilisation des peintures à base de ce produit pour la décoration intérieure a été en grande partie interdite.
Notes et références
- Claudine Biellmann, Stabilité et réactivité des carbonates à particulièrement hautes pression et température : Implications pour le stockage du carbone dans le manteau terrestre, Université de Rennes I, coll. «Mémoires de géosciences Rennes», Rennes, 1993, 230 p. (ISBN 2-905532-54-8) .
Voir aussi
Recherche sur Google Images : |
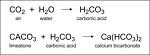
"of calcium carbonate by" L'image ci-contre est extraite du site uwec.edu Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (1842 × 680 - 91 ko - gif)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 09/12/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité