Gibbsite
La gibbsite, de formule chimique Al 3 est un important minerai d'aluminium et l'un des trois composés minéraux qui forment la bauxite.
Recherche sur Google Images :

Source image : futura-sciences.com Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- ... sur place à l'état d'hydroxyde gibbsite. L'atome d'aluminium se trouve en ... la disposition des cristaux de gibbsite est moins régulière et les ... (source : books.google)
- ... Les trois minéraux principaux de la bauxite sont la Gibbsite, Bohmite et le Diaspore. Le Gibbsite est un hydroxyde d'aluminium alors que la... (source : wiki.ggl.ulaval)
|
Catégorie III : oxydes et hydroxydes |
|||
|---|---|---|---|
|
|
|||
|
|
|||
| Catégorie | Minéral | ||
| Formule brute | Al (OH) 3 | ||
| Numéro CAS | |||
|
|
|||
| Masse formulaire | 78 g/mol | ||
| Classe cristalline et groupe d'espace | monoclinique-prismatique 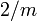 |
||
| Système cristallin | monoclinique | ||
| Clivage | bon à {001} | ||
| Échelle de Mohs | 2, 5-3, 5 | ||
| Éclat | vitreux à mat | ||
|
|
|||
| Indice de réfraction | α=1, 568-1, 570 β=1, 568-1, 570 γ=1, 586-1, 587 | ||
| Biréfringence | Δ=0, 018 ; biaxe négatif | ||
|
|
|||
| Densité | 2, 420 | ||
| Solubilité | insoluble dans l'eau | ||
|
|
|||
| Magnétisme | aucun | ||
| Radioactivité | aucune | ||
|
|
|||
La gibbsite, de formule chimique Al (OH) 3 est un important minerai d'aluminium et l'un des trois composés minéraux qui forment la bauxite. Elle possède une dureté de 2, 5 à 3, 5 et une densité de 2, 3 à 2, 4. La gibbsite a été baptisée du nom de George Gibbs (en) (1776-1833), un collectionneur américain de minéraux, dont la collection a été racquise au cours du XIXe siècle par l'université Yale.
On pense fréquemment à tort que la bauxite est un minéral, mais il s'agit en réalité d'une roche composée d'oxydes et d'hydroxydes d'aluminium dont la gibbsite, la bœhmite (AlO (OH) ) et le diaspore (HAlO2), mais aussi d'argile, de limon et d'oxydes et hydroxydes de fer. La bauxite est une latérite, c'est-à-dire une roche constituée par altération d'autres roches sous des climats tropicaux.
La gibbsite possède trois polymorphes : la bayerite, la doyleite et la nordstrandite. La gibbsite et la bayerite sont monocliniques (groupe d'espace P 2/m), alors que la doyleite et la nordstrandite sont tricliniques.
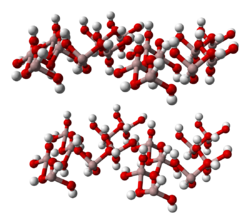
La structure de la gibbsite est analogue à la structure de base des micas. Elle est constituée d'empilements de feuillets d'octaèdres d'hydroxyde d'aluminium. Les octaèdres sont constitués d'un ion central aluminium au degré d'oxydation +III lié en coordination octaédrique à six ions hydroxydes de charge formelle -I. Chaque hydroxyde n'est lié qu'à deux ions aluminium et un tiers des octaèdres ne possèdent pas d'ion aluminium en leur centre. Le feuillet qui en résulte est neutre électriquement +3/6 + -1/2 = 0 (charge +III pour les atomes d'aluminium qui se répartissent sur trois liaisons avec les hydroxydes, charge -I pour les hydroxydes liés à deux aluminium). L'absence de charge sur les feuillets fait qu'il n'y a pas d'ions entre eux pour faire office de «glu» et les maintenir liés par des liaisons ioniques. Ils ne sont liés que par des liaisons faibles ce qui fait que la gibbsite est minéral particulièrement aisément clivable.
La structure de la gibbsite est proche de celle de la brucite Mg (OH) 2. Cependant, les ions magnésium sont dans un état d'oxydation +II, plus faible que celui des ions aluminium dans la gibbsite, et l'électroneutralité des feuillets n'implique plus la présence de sites vacants au centre des octaèdres. La différence de structure et de symétrie entre la gibbsite et la brucite provient de différences dans l'empilement des feuillets.
La couche de type gibbsite forme aussi le «plan de base» de la structure du corindon Al2O3. La structure de base est la même, les ions hydroxydes étant remplacés par des oxygènes. L'oxygène portant une charge +II, les feuillets ne remplissent plus la condition d'électroneutralité, ce qui induit la présence d'ions aluminium entre eux comme compensateurs de charge.
Enfin, la gibbsite est intéressante parce qu'elle est fréquemment rencontrée comme sous-partie de la structure d'autres minéraux. Ainsi les feuillets neutres d'hydroxyde d'aluminium se rencontrent entre des feuillets de silice dans des minéraux argileux comme l'illite, la kaolinite, la montmorillonite. Ils sont semblables aux feuillets rencontrés dans la gibbsite.
Références
- Hurlbut, Cornelius S. ; Klein, Cornelis, 1985, Manual of Mineralogy, 20th ed., ISBN 0-471-80580-7
- Prof. Dr. Martin Okrusch, Prof. Dr. Siegfried Matthes : Mineralogie (7. Aufl. ), Springer Verlag Berlin (2005), ISBN 3-540-23812-3
- Edition Dörfler : Mineralien Enzyklopädie, Nebel Verlag, ISBN 3-89555-076-0
- Webmineral Gibbsite
Sources
- (en) Cet article est partiellement ou en totalité issu de l'article de Wikipédia en anglais intitulé «Gibbsite» (voir la liste des auteurs)
- (de) Cet article est partiellement ou en totalité issu de l'article de Wikipédia en allemand intitulé «Gibbsit» (voir la liste des auteurs)
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 09/12/2010.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité